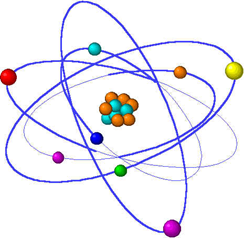
Τα άτομα (=α + τέμνω) είναι πολύ μικρά σωματίδια της ύλης τα οποία συμμετέχουν στο σχηματισμό μορίων.
Δημόκριτος : “ Τα άτομα είναι άφθαρτα και αναλλοίωτα”
Τα στοιχεία τα οποία έχουν ανακαλυφθεί μέχρι σήμερα είναι περίπου 112.
Τα στοιχεία μπορούν να ενωθούν μεταξύ τους κα να σχηματίσουν μόρια :
- Χημικά στοιχεία : μόρια που αποτελούνται από όμοια άτομα πχ H2 , O2 , P4 , S8 .
- Χημικές ενώσεις : μόρια που αποτελούνται από διαφορετικά άτομα πχ H2O , .H3PO4 , C5H10
Αναπαραστάσεις μορίων και ατόμων
Ε-1 Να γίνουν οι αντιστοιχήσεις :
| Α. μόρια στοιχείου Β. μόρια χημικής ένωσης Γ. άτομο | N2 CO2 NH3 C H2 |
Δομή ενός ατόμου :
Το άτομο αποτελείται από ένα πολύ μικρό χώρο στο κέντρο του που ονομάζεται πυρήνας. Ο πυρήνας περιέχει θετικά φορτισμένα υποατομικά σωματίδια που ονομά -ζονται πρωτόνια (p+) και ουδέτερα σωματίδια που ονομάζονται νετρόνια (n 0). Ο πυρήνας έχει μικρό μέγεθος και βρίσκεται στο κέντρο ενός ατόμου το φορτίο του είναι θετικό .
Έξω από τον πυρήνα περιστρέφονται τα αρνητικά φορτι -σμένα υποατομικά σωματίδια τα οποία ονομάζονται ηλεκτρόνια (e-).
Τα άτομα είναι ηλεκτρικά ουδέτερα δηλαδή δεν έχουν φορτίο . Για να συμβεί το παραπάνω θα πρέπει ο αριθμός των πρωτονίων να είναι ίσος με τον αριθμό των ηλεκτρονίων .
Αριθμός πρωτόνια p+ =Αριθμός ηλεκτρόνια (e-).
Ατομικός και μαζικός αριθμός
Κάθε άτομο συνοδεύεται από δύο πολύ σημαντικούς αριθμούς τον ατομικό αριθμό (Ζ) : είναι ο αριθμός των πρωτονίων του στοιχείου και το μαζικό αριθμό (Α): είναι το άθροισμα των πρωτονίων και των νετρονίων μαζί :
Α=Ζ+Ν
όπου Ν= αριθμός νετρονίων .
Κάθε στοιχείο έχει το δικό του Z. Ο αριθμός Ζ χαρακτηρίζει το στοιχείο και θεωρείται “ταυτότητα” του στοιχείο.
Παράδειγμα : Ζ=17 το στοιχείο είναι το χλώριο και συμβολί-ζεται : Cl αν ο ατομικός αριθμός αλλάξει τότε το στοιχείο θα αλλάξει δηλ Ζ=18 το στοιχείο είναι το Αργό που συμβολίζεται Ar.
Π-1 Να βρεθεί ο αριθμός των υποατομικών σωματιδίων στα παρακάτω στοιχεία :
Cl : p+=17 n=35-17=18 e- =17
( στα άτομα ο αριθμός p+ είναι ίσος με τον αριθμό των e- για να είναι ηλεκτρικά ουδέτερο ένα άτομο )