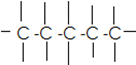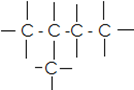Πέμπτη 10 Δεκεμβρίου 2009
Σάββατο 28 Νοεμβρίου 2009
Κυριακή 8 Νοεμβρίου 2009
Αντιδράσεις εξουδετέρωσης
Να γίνουν οι παρακάτω αντιδράσεις εξουδετέρωσης με ιοντική μορφή:
1) ΚΟΗ +ΗCℓ →
2) H2SO4 + NαΟΗ →
3) Ca(OH)2 + HNO3 →
4) HBr + Mg(OH)2 →
5) Aℓ(OH)3 + HCℓ →
6) KOH + H2CO3 →
7) Mg(OH)2 + H2SO4 →
Κυριακή 25 Οκτωβρίου 2009
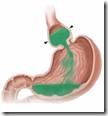
Εξουδετέρωση
Βάσεις

2. Τι θα συμβεί αν σ’ ένα δ/μα ΚΟΗ προσθέσουμε μπλε της βρωμοθυμόλης ή φαινολοφθαλεΐνη;
3. Το δ/μα του ΚΟΗ έχει pH=11 και χαρακτηρίζεται ………………. δηλ έχει μεγαλύτερο αριθμό ιόντων …….. από τον αριθμό ιόντων ………. . Αν σε αυτό το δ/μα προσθέσουμε νερό τότε το pH του θα …………….. .
4. Ποιες είναι οι κοινές ιδιότητες των βάσεων; Που οφείλονται αυτές οι ιδιότητες με βάση τον Arrhenius;
Κυριακή 27 Σεπτεμβρίου 2009
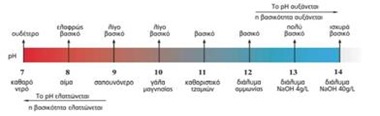
Κλίμακα pH – οξύτητα
Για να απαντήσουμε σ’ αυτήν την ερώτηση πρέπει να σκεφτούμε λίγο αυτά που είπε ο Arrhenius.
Ένα οξύ όταν διαλυθεί στο νερό δίνει Η+ άρα όσα περισσότερα Η+ έχει ένα διάλυμα (σε δεδομένο όγκο) θα είναι πιο όξινο.

Για να μπορέσουμε να άμεσα να μετρήσουμε πόσο όξινο είναι ένα διάλυμα χρησιμοποιούμε την κλίμακα του pH. Όσο μικρότερο το pH ενός διαλύματος τόσο πιο όξινο είναι αυτό.
Τα όξινα δ/τα έχουν pH <7

Η παραπάνω κλίμακα εφαρμόζεται για τη θερμοκρασία των θ=250 C
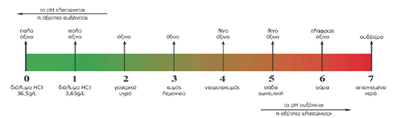
Ποιο το pH του καθαρού νερού ;
Στο καθαρό νερό υπάρχει πολύ μικρός αριθμός Η+ τα οποία προέρχονται από : H2O → H+ + OH-
Ο αριθμός Η+ = αριθμό OH-
Το pH του καθαρού νερού σε θ=250 C είναι ίσο με 7 (pH=7). Τα διαλύματα που έχουν pΗ=7 ονομάζονται ουδέτερα δ/τα.
Στα όξινα δ/τα υπερισχύουν τα Η+ σε σχέση με τα OH- . Δηλαδή ισχύει : αριθμός Η+ >αριθμός OH- και pH<7.
Αν προσθέσουμε νερό (αραίωση) σ’ ένα όξινο δ/μα το pH του αυξάνεται και τείνει προς το 7.
Μέτρηση του pH ενός δ/τος.
Η μέτρηση το pH ενός δ/τος γίνεται με :
Ι. Δείκτες

ΙΙ. πεχαμετρικά χαρτιά
ΙΙΙ. πεχάμετρο ( ακριβέστερα αποτελέσματα).

Δ1: δ/μα με pH=3 και Δ2: δ/μα με pH=2 .
α. Ποιο από τα δύο δ/τα είναι πιο όξινο ; Τι εννοούμε όταν λέμε ότι το δ/μα είναι πιο όξινο σε σχάση με ένα άλλο;
β. Σε ποιο από τα δύο δ/τα πρέπει να προσθέσουμε νερό έτσι ώστε να αποκτήσουν και τα δύο δ/τα την ίδια τιμή pH;
Όλα τα δ/τα έχουν θ=250C.
2. Να γίνει η αντιστοίχηση μεταξύ των δ/των της στήλης Α με τα pH της στήλης Β (θ=250C)
Στήλη Α | Στήλη Β |
1. Αραιό δ/μα ΗCℓ | 1 |
2. πυκνό δ/μα ΗCℓ | 3 |
3. πολύ αραιό δ/μα ΗCℓ | 5 |
7 | |
12 |
Κυριακή 20 Σεπτεμβρίου 2009
Γ΄ γυμνασίου : Οξέα
Οξέα ΗxΑ (Acid)
Λεμόνι , αναψυκτικά , γαλακτικό οξύ , ξίδι και άλλα πολλά οξέα που έχουν σχέση με την καθημερινή μας ζωή .
Θειικό οξύ :vitriol, oil of vitriol, sulfuric acid, sulphuric acid μεθανικό οξύ : formic acid γαλακτικό οξύ :lactic acid , κιτρικό οξύ :citric acid
Τα οξέα παρουσιάζουν κοινές ιδιότητες (όξινος χαρακτήρας) :
- Έχουν ξινή γεύση.
- Αλλάζουν το χρώμα των δεικτών : αν προσθέσουμε μπλε της βρωμοθυμόλης σε διάλυμα οξέος θα γίνει ΚΙΤΡΙΝΟ. Το βάμμα του ηλιοτροπίου γίνεται ΚΟΚΚΙΝΟ.
- Αντιδρούν με ανθρακικά άλατα και ελευθερώνουν αέριο CO2.
Na2CO3(s) + 2HCℓ(aq) →2NaCℓ(aq) + CO2(g) + H2O(ℓ)
Πείραμα : σόδα (ή κιμωλία) και χυμός λεμονιού.
- Ορισμένα μέταλλα αντιδρούν με τα οξέα και ελευθερώνουν αέριο Η2.
Πείραμα : Ζn και δ/μα υδροχλωρίου ΗCℓ δηλ.
Ζn(s) + 2HCℓ(aq) → ZnCℓ2(aq) + H2(g)
Δείκτες είναι χρωστικές ουσίες που έχουν την ιδιότητα να μεταβάλλουν το χρώμα τους κατά την προσθήκη οξέων ή βάσεων. Οι περισσότεροι δείκτες είναι ουσίες που συναντάμε στη φύση και περιέχονται σε ορισμένα φυτικά προϊόντα (πχ. Κόκκινο λάχανο, τσάι κά).
Οξέα κατά Arrhenius
Οξέα ονομάζονται οι ενώσεις οι οποίες όταν διαλυθούν στο νερό δίνουν κατιόντα υδρογόνου (Η+).
Πχ.
■ Υδροχλώριο : HCℓ(aq) → H+(aq) + Cℓ-(aq)
■ Θειικό οξύ : Η2SO4(aq) → 2H+(aq) + SO42-(aq)
■ Νιτρικό οξύ : ΗΝΟ3(aq) → H+(aq) + ΝΟ3-(aq)
Παρατηρούμε ότι όλα τα οξέα δίνουν H+(aq) έτσι εξηγεί ο Arrhenius τις κοινές ιδιότητες των οξέων.
Ερωτήσεις ( θέλουν λίγο ψάξιμο)
- Ποιους άλλους δείκτες (πρωτολυτικούς) μπορούμε να συναντήσουμε στη φύση;
- Πως μπορούμε να διαπιστώσουμε αν το αέριο που ελευθερώνουν οι αντιδράσεις των οξέων με τα ανθρακικά άλατα είναι Η2 ή CO2;
- Ποια μέταλλα δεν αντιδρούν με τα οξέα; (δώστε δύο παραδείγματα)
- Αν προσθέσουμε ένα κομματάκι από φύλο Zn σε αραιό διάλυμα HCℓ σε ποιο σημείο σχηματίζονται οι πρώτες φυσαλίδες Η2 ;
- Τι θα συμβεί (αντίδραση) αν στο νερό διαλύσουμε τις παρακάτω ουσίες;
α. ΗBr β. ΗCℓO4 γ. HI δ. HCOOH ε. H3PO4
Η οξύτητα όλων των διαλυμάτων των οξέων δεν είναι ίδια γιατί ; (to be continued)
Τετάρτη 9 Σεπτεμβρίου 2009
Καλή σχολική χρονιά

Καθηγητές, μαθητές πρέπει να δώσουμε τα δυνατά μας για μια νέα σχολική χρονιά με νέους στόχους , με καλύτερη διάθεση για γνώση , με περισσότερη επικοινωνία και φρέσκες ιδέες που θα μας κάνουν συνεπιβάτες στο απολαυστικό ταξίδι της γνώσης. Η εκπαίδευση είναι ένα “μαγικό παιχνίδι” που θα μας κάνει όλους πιο ευτυχισμένους και από την μεριά των δασκάλων και από τη μεριά των διδασκομένων.
Το παιχνίδι αυτό δεν είναι εύκολο , έχει χαρές αλλά και απογοητεύσεις , αυτό δεν πρέπει να μας πτοεί . Πρέπει να μας δίνει μεγαλύτερο πείσμα για να συνεχίσουμε τον αγώνα.
Πρέπει φέτος να έρθουν πιο κοντά οι μαθητές στη Χημεία αλλά και στις υπόλοιπες ΦΕ. Πώς; Η απάντηση είναι απλή αρκεί να εκμεταλλευτούμε τη δυναμική των Φ.Ε. την εικόνα , το πείραμα να συνδέσουμε τη γνώση με την καθημερινή ζωή , να δώσουμε έμπνευση στους μαθητές να γίνουν πιο δημιουργικοί.
Καλή αρχή
Παρασκευή 29 Μαΐου 2009
Τετάρτη 20 Μαΐου 2009
Πυρηνική ενέργεια ή όχι ;
ΛΟΓΟΣ – ΑΝΤΙΛΟΓΟΣ
Η παγκόσμια οικονομία εδώ και πολλά χρόνια στηρίζεται στην καύση του πετρελαίου (υδρογονανθράκων) με κύριο σκοπό την παραγωγή ενέργειας. Οι επιστήμονες υποστηρίζουν ότι τα αποθέματα σε πετρέλαιο έχουν αρχίσει να μειώνονται δραματικά.
Τι θα γίνει με την ενέργεια ; Οι ανάγκες για ενέργεια αυξάνονται συνεχώς !!!
Πολλοί υποστηρίζουν ότι η πυρηνική ενέργεια είναι μια λύση για την κάλυψη των ενεργειακών αναγκών (λόγος).
Άλλοι υποστηρίζουν ότι η πυρηνική ενέργεια είναι επικίνδυνη και δεν πρέπει να χρησιμοποιηθεί (αντίλογος).
Υποστηρίξτε την άποψη σας (λόγος – αντίλογος) με τη χρήση των σχολίων
Κυριακή 5 Απριλίου 2009
Υδρογονάνθρακες και καύση
Ε-1 Συμπληρώσετε με υδρογόνα τις παρακάτω ενώσεις , να τις ονομάσετε και να γράψετε το ΜΤ καθώς και το ΓΜΤ.
| Συντακτικός Τύπος | ονομασία | ΜΤ | ΓΜΤ |
| α.C –C–C- C | CΗ3–CΗ2–CΗ2-CΗ3 : βουτάνιο | C5H12 | CvH2v+2 |
| β. CΞC-C | | | |
| γ. C=C | | | |
| δ. C–C–C-C-C-C | | | |
| ε. C-C=C-C-C | | | |
| στ. C-C-C-CΞC | | | |
| ζ. C-C-C-C-C=C | | | |
Ε-2 Να γράψετε τους Συντακτικούς Τύπους στις παρακάτω ενώσεις:
| Συντακτικός Τύπος | ονομασία |
| μεθάνιο | |
| προπένιο | |
| CHΞCH | αιθίνιο |
| επτάνιο | |
| πεντίνιο | |
| οκτάνιο | |
| βουτένιο |
E-3 Να γίνουν οι παρακάτω τέλειες καύσεις:
α. C5H10 + O2 →
β. C3H6 + O2 →
γ. C7H12 + O2 →
δ. C2H2 + O2 →
ε. C6H14 + O2 →
στ. βουτάνιο + Ο2 →
ζ. μεθάνιο + Ο2 →
η. προπίνιο + Ο2 →
θ. βουτένιο+ Ο2 →
Κυριακή 15 Μαρτίου 2009
Υδρογονάνθρακες
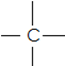
Οι οργανικές ενώσεις είναι οι ενώσεις που περιέχουν άνθρακα C (εκτός από CO2 CO , CO32- )
Ο άνθρακας ανήκει στη 14η ομάδα του Π.Π. άρα έχει 4 ηλεκτρόνια στην εξωτερική στιβάδα επομένως δημιουργεί και 4 δεσμούς.
Οι ενώσεις του άνθρακα μπορεί να αποτελούνται από αλυσίδες με άτομα C :
α. Άκυκλες ενώσεις: ενώσεις που περιέχουν άτομα C στην ευθεία ή σε διακλάδωση
β. Κυκλικές ενώσεις : κλειστές ανθρακικές αλυσίδες.
Επίσης ανάλογα το είδος του δεσμού μεταξύ ατόμων C χωρίζονται ;
i) Κορεσμένες : οι οργανικές ενώσεις που μεταξύ ατόμων άνθρακα έχουν μόνο απλούς δεσμούς.
CH3 – CH2 –CH2 – CH3
ii) ακόρεστες: οι οργανικές ενώσεις που μεταξύ ατόμων άνθρακα υπάρχει τουλάχιστον ένα διπλό ή τριπλό δεσμό .
πχ 1 διπλός δεσμός: CH3 – CH2 –CH = CH2
πχ 1 τριπλός δεσμός: CH3 – C Ξ C - CH3
E-1 Ποιες από τις παρακάτω ενώσεις είναι κορεσμένες και ποιες ακόρεστες;
α. CH3 – CH2 –CH2 –CH3
β. CH3 – CH2 –CΞCH
γ. CH2 =CH –CH =CH2
δ. CH3 – CΗ=Ο
Β’ γυμνασίου : Χημικές αντιδράσεις
1. Να συμπληρώσετε τους συντελεστές για στις παρακάτω αντιδράσεις :
H2 + Cℓ2 → HCℓ
C+H2 → CH4
N2 + O2 → N2O4
S+ O2 → SO3
N2 + H2 → NH3
H2 + O2 → H2O
Cℓ2 + O2 → Cℓ2O5
C + H2 + O2 → C6H12O6
Να γίνουν οι προσομοιώσεις των μορίων για τα αντιδρώντα και τα στις παραπάνω αντιδράσεις.
| H | Cℓ | C | S | N | O |
Σάββατο 7 Μαρτίου 2009
Βιολογία Α΄ γυμνασίου : Εργασίες -Project
Σάββατο 21 Φεβρουαρίου 2009
New !!!! Συνέχεια ασκήσεων και ερωτήσεων στη Χημεία της Β γυμνασίου
Α. Ατομικός –Μαζικός αριθμός και υποατομικά σωματίδια
Α-1 Το στοιχείο Χ διαθέτει ιόν με φορτίο -2 έχει 10 ηλεκτρόνια και 16 νετρόνια να βρεθεί ο ατομικός αριθμός και ο μαζικός αριθμός του στοιχείου Χ.
Α-2 Το σώμα Χ έχει 20 ηλεκτρόνια 18 νετρόνια και 18 πρωτόνια. Το σώμα Χ είναι ανιόν, κατιόν ή άτομο στοιχείου; Ποιος ο ατομικός και ποιος ο μαζικός αριθμός του στοιχείου Χ. Αν από το άτομο του στοιχείου Χ αφαιρέσουμε 3 ηλεκτρόνια τη φορτίο θα έχει το ιόν; Ποιος ο αριθμός των υποατομικών σωματιδίων για το ιόν που προκύπτει;
Α-3 Το ιόν Χ+ έχει ατομικό αριθμό Ζ=35 και Α=72. Να βρεθεί ο αριθμός των υποατομικών σωματιδίων για το ιόν Χ+ ;
Β. Χημικές ενώσεις και σταθερές αναλογίες (μαζών και όγκου)
Β-1 Πόσα g υδρογόνου και πόσα g οξυγόνου περιέχονται σε 72g νερού ;
Β-2 Σε πόσα g νερού υπάρχουν 8g υδρογόνου; Πόσα g οξυγόνου περιέχονται στην παραπάνω ποσότητα του νερού;
Β-3 Αν η αναλογία μαζών στο CO2 είναι mC /mO = 3/8 πόσα g άνθρακα και πόσα g Ο περιέχονται σε 44g CO2;
Β-4 Αν η αναλογία μαζών στο CO2 είναι mC /mO = 3/8. Πόσα g CO2 περιέχουν 1,6g οξυγόνου ;Ποια η ποσότητα του άνθρακα στην παραπάνω ποσότητα του CO2;
Πέμπτη 5 Φεβρουαρίου 2009
Υποατομικά σωματίδια στα άτομα
Ο παρακάτω πίνακας δίνει μερικές πληροφορίες για τα άτομα τεσσάρων στοιχείων Α, Β, Γ και Δ.
| Στοιχείο | Z | A | Αριθμός ηλεκτρονίων | Αριθμός πρωτονίων | Αριθμός νετρονίων |
| Α | 11 | 23 | |||
| Β | 37 | 17 | |||
| Γ | 20 | 20 | |||
| Δ | 17 | 18 |
Άσκηση με ιόντα
1. Να συμπληρωθεί ο πίνακας :
| αριθμός πρωτονίων | αριθμός νετρονίων | αριθμός ηλεκτρονίων | |
Τετάρτη 28 Ιανουαρίου 2009
Άτομα – μόρια - ιόντα
Τα άτομα (=α + τέμνω) είναι πολύ μικρά σωματίδια της ύλης τα οποία συμμετέχουν στο σχηματισμό μορίων.
Δημόκριτος : “ Τα άτομα είναι άφθαρτα και αναλλοίωτα”
Τα στοιχεία τα οποία έχουν ανακαλυφθεί μέχρι σήμερα είναι περίπου 112.
Τα στοιχεία μπορούν να ενωθούν μεταξύ τους κα να σχηματίσουν μόρια :
- Χημικά στοιχεία : μόρια που αποτελούνται από όμοια άτομα πχ H2 , O2 , P4 , S8 .
- Χημικές ενώσεις : μόρια που αποτελούνται από διαφορετικά άτομα πχ H2O , .H3PO4 , C5H10
Αναπαραστάσεις μορίων και ατόμων
Ε-1 Να γίνουν οι αντιστοιχήσεις :
| Α. μόρια στοιχείου Β. μόρια χημικής ένωσης Γ. άτομο | N2 CO2 NH3 C H2 |
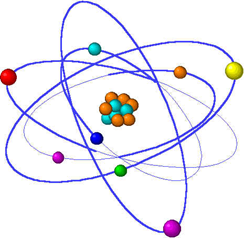
Δομή ενός ατόμου :
Το άτομο αποτελείται από ένα πολύ μικρό χώρο στο κέντρο του που ονομάζεται πυρήνας. Ο πυρήνας περιέχει θετικά φορτισμένα υποατομικά σωματίδια που ονομά -ζονται πρωτόνια (p+) και ουδέτερα σωματίδια που ονομάζονται νετρόνια (n 0). Ο πυρήνας έχει μικρό μέγεθος και βρίσκεται στο κέντρο ενός ατόμου το φορτίο του είναι θετικό .
Έξω από τον πυρήνα περιστρέφονται τα αρνητικά φορτι -σμένα υποατομικά σωματίδια τα οποία ονομάζονται ηλεκτρόνια (e-).
Τα άτομα είναι ηλεκτρικά ουδέτερα δηλαδή δεν έχουν φορτίο . Για να συμβεί το παραπάνω θα πρέπει ο αριθμός των πρωτονίων να είναι ίσος με τον αριθμό των ηλεκτρονίων .
Αριθμός πρωτόνια p+ =Αριθμός ηλεκτρόνια (e-).
Ατομικός και μαζικός αριθμός
Κάθε άτομο συνοδεύεται από δύο πολύ σημαντικούς αριθμούς τον ατομικό αριθμό (Ζ) : είναι ο αριθμός των πρωτονίων του στοιχείου και το μαζικό αριθμό (Α): είναι το άθροισμα των πρωτονίων και των νετρονίων μαζί :
Α=Ζ+Ν
όπου Ν= αριθμός νετρονίων .
Κάθε στοιχείο έχει το δικό του Z. Ο αριθμός Ζ χαρακτηρίζει το στοιχείο και θεωρείται “ταυτότητα” του στοιχείο.
Παράδειγμα : Ζ=17 το στοιχείο είναι το χλώριο και συμβολί-ζεται : Cl αν ο ατομικός αριθμός αλλάξει τότε το στοιχείο θα αλλάξει δηλ Ζ=18 το στοιχείο είναι το Αργό που συμβολίζεται Ar.
Π-1 Να βρεθεί ο αριθμός των υποατομικών σωματιδίων στα παρακάτω στοιχεία :
Cl : p+=17 n=35-17=18 e- =17
( στα άτομα ο αριθμός p+ είναι ίσος με τον αριθμό των e- για να είναι ηλεκτρικά ουδέτερο ένα άτομο )